LABORATORIO DE QUIMICA
Introducción
La química es una ciencia empírica, ya que estudia las cosas por medio del método científico, es decir, por medio de la observación, la cuantificación y, sobre todo, la experimentación. En su sentido más amplio, la química estudia las diversas sustancias que existen en nuestro planeta así como las reacciones que las transforman en otras sustancias. Un ejemplo es el cambio de estado del agua, de líquida a sólida, o de gaseosa a líquida. Por otra parte, la química estudia la estructura de las sustancias a su nivel molecular. Y por último, pero no menos importante, sus propiedades.
En el presente trabajo se desarrollan temas de la química como los compuestos orgánicos e inorgánicos, las propiedades físicas y mecánicas de los elementos, las reacciones químicas y la ley de la conservación de la masa.
Objetivos
Los objetivos en Química son:
- inculcar el interés por el aprendizaje de la Química, que les permita valorar sus aplicaciones en diferentes contextos e involucrarlos en la experiencia intelectualmente estimulante y satisfactoria de aprender y estudiar.
- Proporcionar una base sólida y equilibrada de conocimientos químicos y habilidades prácticas.
- Desarrollar la habilidad para aplicar sus conocimientos químicos, teóricos y prácticos, a la solución de problemas en Química.
- Desarrollar, mediante la educación en Química, un rango de habilidades valiosas tanto en aspectos químicos como no químicos.
- Proporcionar una base de conocimientos y habilidades con las que pueda continuar sus estudios en áreas especializadas de Química o áreas multidisciplinares.
- Generar la capacidad de valorar la importancia de la Química en el contexto industrial, económico, medioambiental y social.
BALANCEO DE ECUACIONES
Balancear una ecuación es realmente un procedimiento de ensayo y error, que se fundamenta en la búsqueda de diferentes coeficientes numéricos que hagan que el numero de cada tipo de átomos presentes en la reacción química sea el mismo tanto en reactantes como en productos
Hay varios métodos para equilibrar ecuaciones:
1. MÉTODO DEL TANTEO O INSPECCIÓN
Este método es utilizado para ecuaciones sencillas y consiste en colocar coeficientes a la izquierda de cada sustancia, hasta tener igual número de átomos tanto en reactantes como en productos.
EJEMPLO:
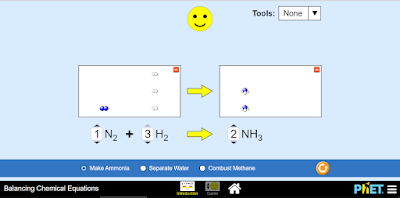
N2 + H2 → NH3
En esta ecuación hay dos átomos de nitrógeno en los reactantes, por tanto se debe colocar coeficiente 2 al NH3, para que en los productos quede el mismo número de átomos de dicho elemento.
N2 + H2 → 2NH3
Al colocar este coeficiente tenemos en el producto seis átomos de hidrógeno; para balancearlos hay que colocar un coeficiente 3 al H2 reactante:
N2 + 3H2 → 2NH3
La ecuación ha quedado equilibrada. El número de átomos de cada elemento es el mismo en reactivos y productos.
2. MÉTODO DE OXIDO REDUCCIÓN
Para utilizar éste método es necesario tener en cuenta que sustancia gana electrones y cual los pierde, además se requiere manejar los términos que aparecen en la siguiente tabla:
BALANCEO DE ECUACIONES CAMBIO EN ELECTRONES CAMBIO DE NÚMERO DE OXIDACIÓN
Oxidación Perdida Aumento
Reducción Ganancia Disminución
Agente oxidante
( sustancia que se reduce) Gana Disminuye
Agente reductor
( sustancia que se oxida) Pierde Aumenta
Como los procesos de oxido-reducción son de intercambio de electrones, las ecuaciones químicas estarán igualadas cuando el número de electrones cedidos por el agente oxidante sea igual al recibido por el agente reductor. El número de electrones intercambiados se calcula fácilmente, teniendo en cuenta la variación de los números de oxidación de los elementos.
OXIDACIÓN Y REDUCCIÓN
Oxidación: Es la perdida de electrones acompañada de un aumento en el numero de oxidación de un elemento hacia un valor mas positivo.
Ejemplo: cuando el Zn reacciona con HCl, cada átomo de Zn pierde dos electrones y aumenta su numero de oxidación de 0 o +2.
Zn + HCl --- Zn2 Cl2 + H2
Zn° - 2e --- Zn2 Oxidación
Reducción: Es la ganancia de electrones acompañada de una disminución de numero de oxidación hacia un valor menos positivo.
ZH1 + 2e --- H2° Reducción
Agente Oxidante: Es el elemento o compuesto que capta electrones para reducirse los metales se comportan como oxidante, este carácter aumenta al crecer la afinidad electrónica.
- Los alogenos y el oxigeno son agentes oxidantes muy energéticos.






Comentarios
Publicar un comentario